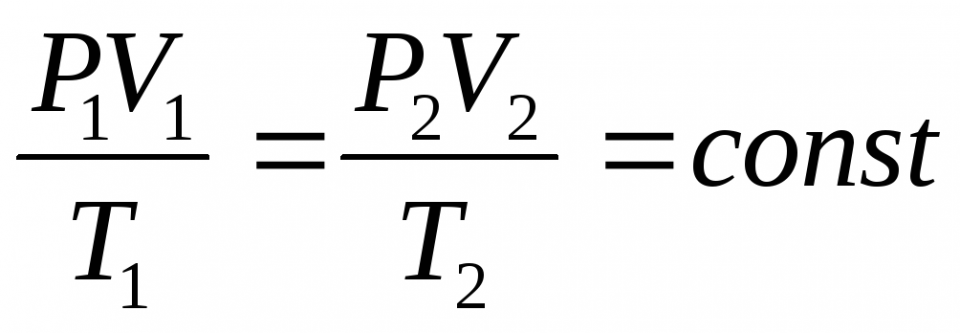Уявіть, що ви стискаєте повітряну кульку, і вона зменшується в розмірах, а повітря всередині стає щільнішим. Або навпаки: надуваєте її, і кулька розширюється, стаючи більшою. Ці явища, які ми інтуїтивно розуміємо, описує один із фундаментальних законів фізики — закон Бойля-Маріотта. Ця стаття занурить вас у світ газів, тиску й об’єму, розкриваючи, як цей закон працює, де застосовується і чому він такий важливий.
Що таке закон Бойля-Маріотта?
Закон Бойля-Маріотта — це фізичний принцип, який описує залежність між тиском і об’ємом ідеального газу за незмінної температури. Простіше кажучи, якщо ви стиснете газ, не змінюючи його температури, тиск зросте, а якщо дасте газу розширитися, тиск зменшиться. Формула цього закону виглядає так:
P₁V₁ = P₂V₂
Тут P₁ і V₁ — початкові тиск і об’єм газу, а P₂ і V₂ — кінцеві. Ця формула показує, що добуток тиску й об’єму завжди залишається сталим, якщо температура не змінюється.
Історична довідка: Хто такі Бойль і Маріотт?
Закон названо на честь двох видатних учених XVII століття: Роберта Бойля та Едме Маріотта. Роберт Бойль, англійський фізик і хімік, у 1662 році опублікував результати своїх експериментів із газами, описавши залежність між тиском і об’ємом. Едме Маріотт, французький фізик, незалежно дійшов до тих самих висновків у 1676 році, додавши уточнення про незмінність температури. Сьогодні закон носить імена обох учених, хоча в деяких країнах його називають просто законом Бойля.
Як працює закон: Просте пояснення складного явища
Щоб зрозуміти закон Бойля-Маріотта, уявіть газ як натовп маленьких частинок, що гасають у закритому просторі. Ці частинки постійно вдаряються об стінки посудини, створюючи тиск. Якщо ви зменшите об’єм посудини, частинки матимуть менше місця для руху, вдарятимуться частіше, і тиск зросте. І навпаки: більший об’єм — рідші зіткнення — менший тиск.
Математична суть закону
Формула P₁V₁ = P₂V₂ — це не просто рівняння, а ключ до розуміння поведінки газів. Наприклад, якщо об’єм газу зменшується вдвічі, тиск зростає вдвічі, щоб зберегти добуток сталим. Ось практичний приклад:
- У вас є 2 літри газу під тиском 1 атмосфера.
- Ви стискаєте газ до 1 літра (об’єм зменшується вдвічі).
- Тиск зростає до 2 атмосфер, адже 1 × 2 = 2 × 1.
Цей зв’язок називають обернено пропорційним: коли одна величина зростає, інша зменшується, і навпаки.
Умови дії закону: Чому температура важлива?
Закон Бойля-Маріотта працює лише за ізотермічних умов, тобто коли температура газу залишається сталою. Чому це так? Температура впливає на швидкість руху частинок газу. Якщо вона зростає, частинки рухаються швидше, тиск збільшується, і закон перестає бути справедливим без додаткових коригувань.
У реальному світі ідеально ізотермічні умови рідкісні, але закон добре описує поведінку газів у ситуаціях, де температура змінюється незначно, наприклад, у шприцах, балонах для дайвінгу чи навіть у ваших легенях під час дихання.
Практичне застосування закону Бойля-Маріотта
Закон Бойля-Маріотта — не просто абстрактна теорія, а принцип, який ми використовуємо щодня, часто навіть не усвідомлюючи цього. Ось кілька сфер, де він відіграє ключову роль:
Медицина
У медицині закон застосовується в апаратному диханні. Вентилятори легень регулюють об’єм повітря, що надходить до легень, змінюючи тиск. Наприклад, коли об’єм повітря в апараті зменшується, тиск зростає, проштовхуючи повітря в легені.
Дайвінг
Дайвери добре знають про закон Бойля-Маріотта. Під водою тиск зростає з глибиною, стискаючи повітря в балонах і легенях. Якщо дайвер спливає занадто швидко, об’єм повітря в легенях різко збільшується через зниження тиску, що може призвести до травм.
Промисловість
У промислових компресорах закон допомагає стискати гази для зберігання чи транспортування. Наприклад, природний газ стискають у балонах, зменшуючи його об’єм і підвищуючи тиск для зручного використання.
Повсякденне життя
Коли ви накачуєте велосипедну шину чи використовуєте аерозольний балончик, ви застосовуєте закон Бойля-Маріотта. Стискання газу підвищує тиск, дозволяючи, наприклад, фарбі чи дезодоранту вийти з балончика.
Порівняння ідеальних і реальних газів
Закон Бойля-Маріотта ідеально працює для так званих ідеальних газів — теоретичних моделей, де частинки не взаємодіють між собою і не займають об’єму. Але в реальному світі гази, як-от кисень чи азот, мають певні відхилення від ідеальної поведінки, особливо за високих тисків чи низьких температур.
Щоб проілюструвати різницю, розглянемо таблицю:
| Характеристика | Ідеальний газ | Реальний газ |
|---|---|---|
| Взаємодія частинок | Відсутня | Присутня (ван-дер-ваальсові сили) |
| Об’єм частинок | Нульовий | Має об’єм |
| Відповідність закону | Повна | Приблизно за низьких тисків |
Джерело: Підручники з фізичної хімії, science.gov.
Для реальних газів учені використовують рівняння ван дер Ваальса, яке враховує ці відхилення, але для більшості практичних завдань закон Бойля-Маріотта залишається достатньо точним.
Цікаві факти про закон Бойля-Маріотта
Закон Бойля-Маріотта не лише вирішує задачі з підручників, але й має дивовижні прояви в природі та технологіях. Ось кілька фактів, які вас здивують:
- 🌬️ Дихання риб. Зябра риб працюють за принципом закону: зміна об’єму порожнини змінює тиск, дозволяючи воді надходити до зябер.
- ⭐ Космічні технології. У космосі закон допомагає регулювати тиск у скафандрах, щоб астронавти могли дихати.
- 🔥 Вибухові експерименти. Бойль використовував ртуть для своїх дослідів, що було небезпечно, але дало точні результати.
- 🌊 Підводні вулкани. Закон пояснює, як газові бульбашки в океані розширюються, наближаючись до поверхні.
Ці факти показують, наскільки універсальним є закон, проникаючи в найнесподіваніші куточки науки й природи.
Як розв’язувати задачі за законом Бойля-Маріотта
Розв’язування задач за законом Бойля-Маріотта — це захопливий процес, схожий на розгадування пазла. Ось покроковий алгоритм:
- Запишіть відомі дані. Визначте P₁, V₁, P₂ або V₂. Переконайтеся, що одиниці сумісні (наприклад, літри для об’єму, паскалі для тиску).
- Використайте формулу P₁V₁ = P₂V₂. Підставте відомі значення.
- Розв’яжіть рівняння. Знайдіть невідому величину, виразивши її через інші.
- Перевірте результат. Переконайтеся, що обернена пропорційність виконується.
Приклад: У балоні об’ємом 10 л газ перебуває під тиском 2 атм. Яким буде тиск, якщо об’єм зменшиться до 5 л?
- P₁ = 2 атм, V₁ = 10 л, V₂ = 5 л, P₂ = ?
- 2 × 10 = P₂ × 5
- P₂ = (2 × 10) / 5 = 4 атм
Відповідь: тиск зросте до 4 атмосфер. Такі задачі допомагають не лише зрозуміти закон, але й відчути його практичну цінність.
Обмеження закону та сучасні дослідження
Хоча закон Бойля-Маріотта є потужним інструментом, він має обмеження. За дуже високих тисків або низьких температур реальні гази відхиляються від ідеальної моделі. Сучасні вчені використовують складніші моделі, як-от рівняння стану реальних газів, щоб передбачити їхню поведінку.
У 2024 році дослідники з MIT опублікували статтю в журналі Physical Review Letters, де показали, як квантова механіка може впливати на поведінку газів за екстремальних умов, відкриваючи нові горизонти для застосування закону.
Ці дослідження показують, що закон Бойля-Маріотта залишається актуальним, але наука постійно розширює його межі.
Чому закон Бойля-Маріотта важливий для кожного?
Цей закон — не просто формула з підручника, а ключ до розуміння світу навколо нас. Від дихання до космічних польотів, від промислових процесів до природних явищ — він пронизує наше життя. Вивчаючи його, ми не лише дізнаємося, як працюють гази, але й відкриваємо двері до глибшого розуміння природи.
Наступного разу, коли ви надуватимете повітряну кульку чи занурюватиметесь під воду, згадайте про Бойля й Маріотта. Їхній закон — це невидима нитка, що пов’язує нас із Всесвітом, де кожен рух частинок має свої правила й гармонію.